Diese dem U.S. Surgeon General Dr. William H. Stewart – wahrscheinlich fälschlicherweise – zugeschriebene Äußerung aus dem Jahr 1967 spiegelt die Euphorie einer Zeit wieder, in der die Behandlung bakteriell verursachter Infektionen dank der rasanten Entwicklung hoch wirksamer Antibiotika regelmäßig so erfolgreich verlief, dass man meinte, die Infektionskrankheiten besiegt zu haben. In den Jahren zuvor waren zahlreiche neue Wirkstoffe, wie etwa Penicilline, Tetrazykline, Cephalosporine und Makrolide, in die klinische Medizin eingeführt worden und weitere pharmazeutische „Wunderwaffen“, allen voran Fluorchinolone und Carbapeneme, sollten folgen. Auch wenn bei jeder Substanzklasse schon bald über erste resistente Bakterienstämme berichtet wurde, schien das „Füllhorn“ der pharmazeutischen Industrie unermesslich groß zu sein. Mahnungen, mit diesen Substanzen rational – vernünftig – umzugehen, wurden offenkundig genauso wenig beachtet wie die Einhaltung wichtiger Hygieneregeln, deren konsequente Anwendung eine Ausbreitung von Krankheitserregern im Hospitalumfeld wirksam zu verhindern vermag.
Mitte der neunziger Jahre des vergangenen Jahrhunderts führten dann alarmierende epidemiologische Daten in Deutschland und vielen andern Staaten zu einem radikalen Umdenken im Umgang mit klinisch relevanten Mikroorganismen. Das Bakterium Staphylococcus aureus, Verursacher zahlreicher schwerer Erkrankungen wie etwa der Sepsis (Blutvergiftung), der infektiösen Endokarditis (Herzinnenhautentzündung), der Lungenentzündung oder von Wund- und Weichteilinfektionen, zeigte in zunehmendem Ausmaß eine Unempfindlichkeit gegenüber gerade solchen Penicillinpäparaten, die zur Behandlung besonders resistenter Bakterien dieser Art auf den Markt gebracht worden waren. Es bedurfte bis heute erheblicher gesundheitspolitischer Anstrengungen, um das Problem der Ausbreitung dieser Methicillin-resistenten Staphylococcus aureus-(MRSA-) Stämme, die immer gegen eine Vielzahl von Antibiotika resistent sind, in den Griff zu bekommen. Dazu zählen insbesondere spezielle Behandlungsmaßnahmen einschließlich der Isolierung der Patienten in Einzelzimmern, kostenintensive Laboruntersuchungen und die Entwicklung neuer Medikamente.
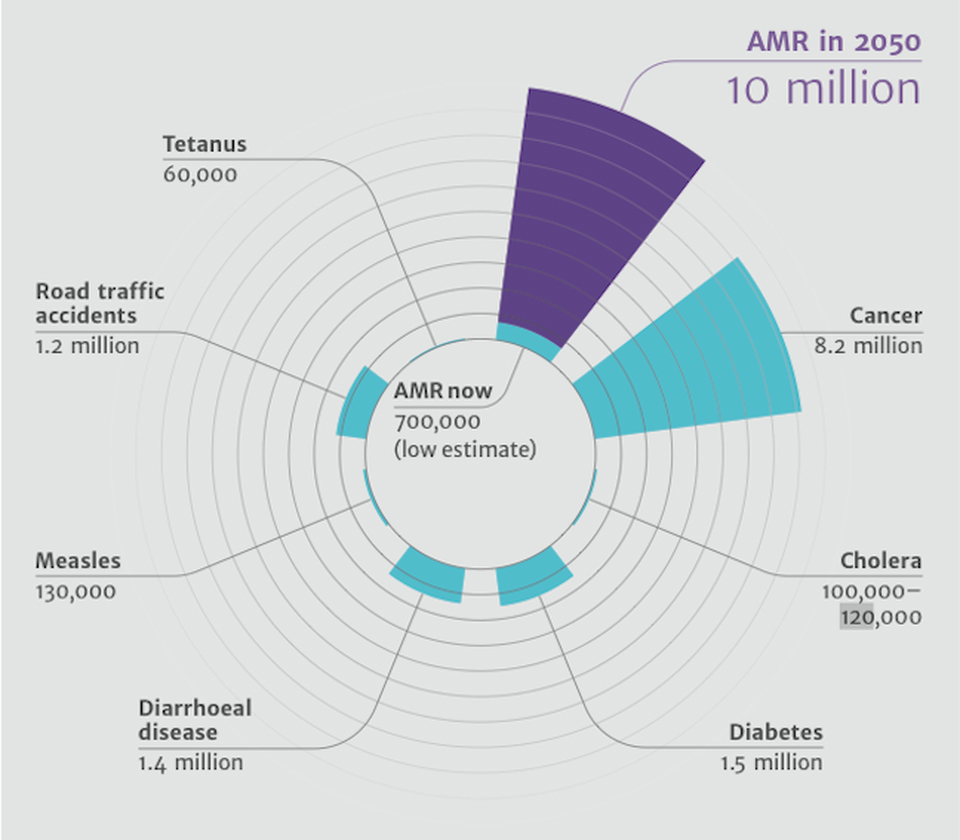
Die Ursachen für die zunehmende Verbreitung multiresistenter Erreger (MRE) sind vielfältig. Von entscheidender Bedeutung ist der jahrzehntelange Fehl- und Übergebrauch von Antibiotika in der Human- und der Veterinärmedizin. Die breite Verwendung von antimikrobiellen Substanzen in der Tiermast, die unkontrollierte Einleitung antibiotikahaltiger Abwässer in die Umwelt, der inadäquate Einsatz von antibakteriell wirksamen Medikamenten zur Behandlung von Erkältungen und anderer banaler Viruserkrankungen und der unkritische „Over the counter“-Verkauf dieser Arzneimittel in Ländern mit unterentwickelter Gesundheitsversorgung haben sich in Verbindung mit den Verbreitungsmöglichkeiten im Zuge des internationalen Reiseverkehrs zu einer der größten gesundheitspolitischen Herausforderung unserer Zeit entwickelt. Schätzungen einer britischen Expertenkommission aus dem Jahr 2016 gehen davon aus, dass im Jahr 2050 weltweit etwa 10 Millionen Menschen an einer Infektion versterben könnten, die durch einen multiresistenten Erreger hervorgerufen wird. Das wären möglicherweise sogar mehr Todesopfer als durch Krebserkrankungen. Nicht zuletzt die Weltgesundheitsorganisation (WHO) spricht hier vom drohenden post-antibiotischen Zeitalter und mahnt unverzügliches Handeln an.
Von großer Bedeutung ist allerdings auch die Entwicklung von Therapieprinzipien, die andere Wege beschreiten als die klassische Antibiotikagabe. Die vor 100 Jahren erstmals klinisch erprobte antimikrobielle Wirkung von Bakterien zerstörenden Viren, sogenannten Bakteriophagen, war im Zuge des „Antibiotika-Hypes“ der westlichen Infektionsmedizin des 20. Jahrhunderts weitgehend in Vergessenheit geraten. Weiter gepflegt in osteuropäischen Ländern wie etwa Georgien rückt diese Behandlungsstrategie angesichts des drohenden „postantibiotischen Zeitalters“ zunehmend wieder in den Focus des wissenschaftlichen Interesses.
Das Gemeinschaftsprojekt „PhagoFlow“ der Konsortialpartner BwKrhs Berlin, DSMZ und Fraunhofer-ITEM ist eins der Forschungsvorhaben, das die Hypothese der antibakteriellen Wirkung spezieller Viren aufgreift und die praktische Anwendbarkeit in einem klinischen Kontext überprüft.
Das Buch der Infektionskrankheiten ist also nach wie vor geöffnet. Ob wir gut 90 Jahre nach Entdeckung der bakterienhemmenden Wirkung des Penicillins durch Alexander Fleming den Kampf gegen die „Pestilenz“ als Synonym für aller übertragbaren Erkrankungen gewinnen werden, ist unsicherer denn je; es hängt auch vom Erfolg therapeutischer Strategien „jenseits“ der Antibiotikaverordnung ab!